
西北大学科研团队《自然》发文:推动揭示2型糖尿病等复杂遗传病的分子机制
北京时间1月28日凌晨,《自然》(Nature)杂志发表了西北大学生命科学与医学部功能基因组学研究组严健教授团队及其合作者的最新研究成果《系统解析非编码DNA突变对转录因子结合的影响》,在国际上首次公布了该团队成功利用SNP-SELEX技术,分析人类基因组中95886个常见的非编码位点突变对270个转录因子蛋白质结合的影响,研究结果为揭示2型糖尿病等复杂疾病的遗传机制提供了重要的理论依据,是后基因组时代的一项突破性研究进展。

《自然》(Nature)杂志发表了西北大学生命科学与医学部功能基因组学研究组严健教授团队及其合作者的最新研究成果《系统解析非编码DNA突变对转录因子结合的影响》
一般来讲,人与人之间在基因组DNA序列上存在约千分之一甚至更小的差异,这些差异往往导致了个体间遗传性状的差别。比如,在同样生活环境下,有的个体患2型糖尿病的风险更高。目前的遗传学研究主要利用全基因组关联分析(GWAS)寻找与复杂遗传疾病关联的基因位点,但GWAS在找到基因序列差异与疾病风险关联的时候,并不能同时反映出这种关联背后的原理,这就阻碍了我们从关联中寻找预防和治疗这些疾病的分子靶标,成为一直困扰遗传学和医学研究者的一大难题。
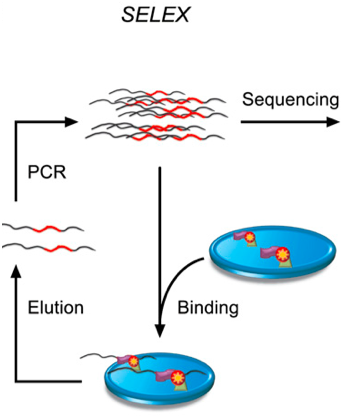
SELEX原理示意图:红色波浪线表示长度为40bp的双链DNA片段,每一轮循环表示一次富集过程,可以通过增加循环来提高富集度。
该文以遗传研究已有基础较为丰富的2型糖尿病为基础,从已知与该病关联的突变入手,以高通量手段揭示了大量突变在分子水平的生物学功能,并验证了部分突变引起细胞代谢变化的原理,为2型糖尿病的临床治疗提供了重要的理论基础。“之前的类似研究都是以单个或几个突变作为对象,这样要完全了解2型糖尿病这样同时受到几百上千个突变影响的复杂疾病,在短时间内是无法完成的,大大阻碍了开发治疗手段的进程。而这项研究一下子就解决了近10万个突变的分子机制问题,是一项重大突破。”论文共同通讯作者之一、第一作者严健说。
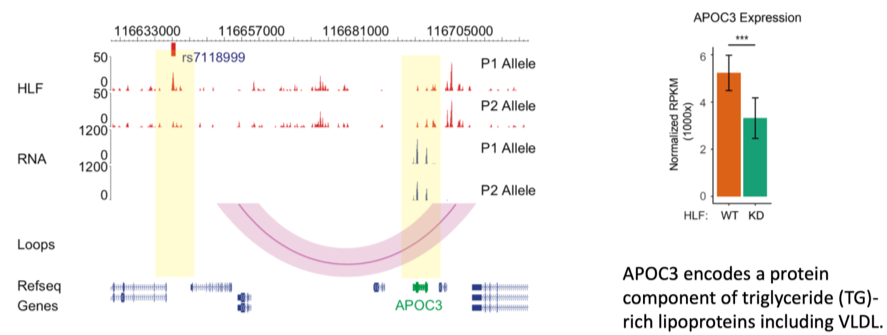
左图展示了在基因组浏览器中观察到的SNP rs7118999可以影响HLF转录因子的亲和力,从而通过三维基因组折叠的方式,引起下游APOC3基因表达的差异。右图展示了在肝脏细胞中敲低HLF会导致APOC3基因表达的下降,进一步验证了该团队的科学假设。
严健同时介绍到:“以此为基础,我们相信类似的研究手段可以进一步扩展到其他遗传疾病的研究中,包括肠癌、前列腺癌等,将对解释这类疾病的遗传特性,找到临床诊断的分子标记物等工作都具有建议和指导作用。”
严健带领的功能基因组研究团队自2018年建立以来,在非编码基因组功能方向的研究取得一系列重大突破。此前,严健还以通讯作者身份在《自然方法》(Nature Methods)、《自然通讯》(Nature Communications)、《核酸研究》(Nucleic Acids Research)等国际知名期刊发表论文多篇。
该成果由中国西北大学、美国路德维西癌症研究所(任兵教授团队,本文共同通讯作者)、瑞典卡罗林斯卡医学院(Jussi Taipale教授团队,本文共同通讯作者)等单位合作完成,是西北大学生命科学与医学部自成立以来的首篇Nature杂志论文,也是以西北大学为第一作者单位在Nature和Science正刊发表的第16篇论文,是学校科学研究多点突破的标志性成果。
近年来,西北大学在持续推进“一院一策”改革的基础上,逐步打破学科边界,围绕学科交叉融合,促进学术协同创新,加快论证推进相关学科大部的建立。生命科学与医学部作为学校首家学部制试点单位,立足“大健康”学科集群,凝练和突出生物与医学学科优势特色,构建跨学科创新团队,建设大平台、承担大项目、产出大成果,逐步形成了面向国家需求、服务区域发展、彰显西大特色的“大健康”学科内涵式发展新路径。
联系人:西北大学党委宣传部 魏梦鸽 18220574055
稿件来源:西北大学




